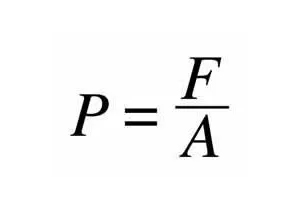ترموديناميک و انرژی
ترمودینامیک:
ترمودینامیک را می توان علم انرژی تعریف كرد . اگر چه هر كس احساسی خاص از انرژی دارد اما به طور كلی ارائه تعریف دقیقی از آن مشكل می باشد . انرژی می تواند به عنوان توانایی به وجود آوردن تغییرات در نظر گرفته شود . نام ترمودینامیك از كلمات یونانی Thrme (حرارت) و Dynamis ( قدرت حرارت )گرفته شده است كه بیشتر به نظور تشریح تلاشهای اولیه تبدیل حرارت به قدرت به كار می رود امروزه همین نام به صورت گسترده ای برای تمام جنبه های انرژی و تبدیلات آن شامل تولید قدرت ، تبرید و روابط بین خواص و ماده نیز تفسیر می گردد .
یكی اساسی ترین قوانین طبیعت ، اصل بقای انرژی می باشد . این اصل به سادگی بیان می كند كه در طی یك برهمكنش ( تأثیر متقابل ) انرژی می تواند از یك شكل به شكل دیگر تغییر یابد ، ولی مقدار كل انرژی ثابت باقی می ماند . بدان معنا كه انرژی نه می تواند خلق شود و نه نابود گردد . به طور مثال سنگی كه از روی یك صخره سقوط می كند به غلت تبدیل انرژی پتانسیل آن به انرژی جنبشی سرعت می گیرد.
برای مثال قانون اول ترمودینامیك بیانی ساده از بقای انرژی است و نتیجه می گیرد كه انرژی یك خاصیت ترمودینامیكی است .قانون دوم ترمودینامیك معین می كند كه انرژی دارای كمیت و كیفیت می باشد و فرآیند واقعی در جهتی اتفاق می افتد كه كیفیت انرژی كاهش یابد . به عنوان مثال چنانچه فنجانی حاوی قهوه روی میزی قرار گیرد قهوه به تدریج سرد می شود ، اما فنجان دیگری حاوی قهوه سرد كه روی همان میز قرار دارد ، مسلما ً به خودی خود گرم نمی شود .هر چند كه اصول ترمودیناك ازابتدای خلقت جهان وجود داشته اند ولی ترمودینامیك به عنوان یك علم تا ساخت اولین موتور های موفقیت آمیز بخاری آتمسفریك در انگلستان توسط Tomas Savery در سال 1697 و Tomas Newcomen در سال 1712 مورد توجه واقع نشد . این ماشین ها بسیار آهسته و بابازده كم بودند ، اما راه را برای توسعه یك علم جدید باز نمودند قوانین اول و دوم ترمودینامیك به طور همزمان از كارهای اولیه Wiliam Rankine ، Rodulph Clausius و Lord Kelvin ( نام قبلی او Wiliam Thomson ) در سالهای 1850 بیرون آمد . واژه ترمودینامیك برای اولین بار در مقاله ای از Lord Kelvin در سال 1849 به كار برده شد . اولین كتاب درس ترمودینامیك در ستال 1859 بوسیلهWiliam Rankine استاد دانشگاه گلاسكو نوشته شد .مطالعه ترمودینامیك از نقطه نظر ماكروسكوپی كه ننیاز به دانستن رفتار تك تك ذرات نمی باشد ، ترمودینامیك كلاسیك نامیده می شود كه راهی آسان و مستقیم برای حل مسائل مهندسی راارائه می دهد . دیدگاه پیچیده تری كه بر اساس میانگین رفتار گروه بزرگی از ذرات مشخص ، بنا شده ترمودینامیك آماری خوانده می شود .
فشار :
نیروی اعمال شده بر واحد سطح یك سیال را ، فشار می گویند . سخن از فشار هنگامی به میان می آید كه با یك گاز یا یك مایع سر و كار داریم . معادل فشار در جامدات تنش است . در یك سیال فشار در هر نقطه ، در تمام جهات یك سان است و فشار درون یك سیال به علت وزن سیال با عمق افزایش می یابد . این بدین علت است كه سطوح زیرین سیال وزن بیشتری نسبت به سطوح فوقانی تحمل می كنند . فشار در جهت عمودی به علت تأثیرات جاذبه تفییر می كند ، اما در جهت افقی هیچ گونه در فشار روی نخواهد داد . ممكن است فشار یك مخزن حاوی گاز ، یكنواخت فرض شود ، زیرا كه وزن گاز آنقدر كم است كه نمی تواند تغییری قابل توجه در فشار گاز درون مخزن ایجاد كند . از آنجا كه فشار به صورت نیرو بر واحد سطح نتعریف می گردد ز آنجا كه فشار به صورت نیرو بر واحد سطح نتعریف می گردد ز آنجا كه فشار به صورت نیرو بر واحد سطح نتعریف می گردد ، واحد آن نیوتن بر متر مربع (N/m2 ) است كه پاسكال ( Pa ) نامیده می شود :1 Pa = 1 N/m2
واحد پاسكال نسبت به فشارهای كه در عمل با آن سر و كار داریم بسیار كوچك است لذا واحدهای بزرگتری از جمله كیلو پاسكال ( 1 KPa = 103 Pa ) و مگا پاسكال ( 1 MPa = 106 Pa ) ، استفاده می شود . دو واحد دیگر فشار ، بار و اتمسفر استاندارد بدین صورت تعریف می گردند : 1 bar = 105 Pa = 0.1 MPa = 100 KPa
انتقال حرارت :
به طور تجربی همه می دانیم كه قوطی نوشابه سردی كه روی میزی قرار دارد به آرامی گرم می شود و یك سیب زمینی تنوری داغ كه روی همان میز قرار دارد به آهستگی سرد می شود .
هنگامی كه یك جسم در محیطی كه با آن اختلاف دما دارد ، رها شود ، تبادل انرژی بین جسم و محیط اطراف تا رسیدن به تعادل گرمایی صورت می گیرد ، یعنی جسم و محیط به دمای یكسانی می رسند . جهت انرژی انتقال یافته ، همیشه از جسم با دما یبالاتر به سمت جسم با دمای پائین تر است . در مثال سیب زمینی پخته شده ، تبادل انرژی تا زمانی كه سیب زمینی به دمای اتاق نرسیده ، ادامه می یابد . لذا تا زمانی كه تساوی دمائی ایجاد نشده انتقال انرژی قطع نمی گردد . در فرآیندهایی كه در بالا توضیحداده شد ، انرژی به شكل گرما جا به جا می شود .
گرما را می توان به صورت ‹‹ شكلی از انرژی كه بین دو سیستم ( یا یكك سیستم و محیط اطرافش ) به علت یك اختلاف دما انتقال می یابد. ›› تعریف كرد .بدین معنی كه به علت اختلاف دما جابه جایی انرژی فقط به صورت گرما امكان پذیر است . در نتیجه بین دو سیستمی كه دارای دمای مساویند هیچ گونه انتقال دما ، نمی تواند وجود داشته باشد .
منابع انرژی حرارتی :
در ادامه بسط قانون دوم ترمودینامیك ة بسیار مناسب است كه یك جسم فرضی با ظرفیت انرژی حرارتی ( جرم × گرمای ویژه ) زیاد داشته باشیم كه توانایی جذب یا عرضه مقدار انرژی حراتی محدودی بدون تغییر دما را داشته باشیم . سچنین جسمی كه یم منبع انرژی حرارتی یا فقط یك منبع نام دارد . در عمل ، مقاذیر بسیار زیاد آب مانند اقیانوس ها ، دریاچه ها رودخانه ها و همینطور همای اتمسفری را دقیقأ می توان به عنوان منابع انرژی حرارتی در نظر گرفت . زیرا دارای قابلیت های زیادی در ذخیره سازی مقادیر انرژی حرارتی ، یا جرمهای حرارتی زیاد ، می باشند . برای مثال در زمستان بر اثر حرارت دفع شده از منازل مسكونی اتمسفر گرم نمی شود . به علاوه مقادیر بسیار زیاد انژی دفع شده از نیروگاه ها به داخل رودخانه ها، تغییر دمای قابل ملاحظه ای را در آب رودخانه ها ایجاد نمی كند .برای اینكه یتوان جسمی را به صورت یك منبع انرژی در نظر گرفت ، لزومی ندارد ان جسم خیلی بزرگ باشد . هر جسم فیزیكی كه ظرفیت انرژی حرارتی آن نسبت به مقدار انرژی كه تولید یا دفع می كند بالا باشد ، را می توان یك منبع انرژی در نظر گرفت .
برا ی مثال هوای یك اتاق را در ازای حرارت دفع شده از یك دستگاه تلویزیون در داخل اتاق را می توان یك منبع در نظر گرفت ، زیرا مقدار گرمای دفع شده از تلویزیون برای ایجاد تغیرات زیاد دما در هوای اتاق كافی نیست .
موتورهای حرارتی
تبدیل كار انواع اشكال انرژی به سادگی امكان پذیر است ولی تبدیل انواع انرژیبه كار ، آسان نمی باشد . تبدیل كار به انرژی مستقیما ً و تماما ً صورت می گیرد ولی تبدیل انرژی به كار مستلزم وجود تجهیزات خاصی است ، كه موتورهای حرارتی نامیده می شود .
موتورهای حرارتی تفاوتهای زیادی با یكدیگر دارند ولی همگی آنها را می توان در قالبهای زیر مشترك دانست :
1. آنها حرارت را از یك منبع با دمای بالا ( انرژی خورشیدی ، كوره های نفتی ، رآكتورهای هسته ای و غیره … ) دریافت می كنند .
2. آنها بخشی از حرارت را به كار تبدیل می كنند .( معمولا ً به صورت محور دوّار )
3. آنها حرارت باقی مانده را به صورت تلفات به یك چاهك ( تمسفر ، رودخانه ها و غیره … ) با دمای پائین ، انتقال می دهند .
4. آنها در یك چرخه كار می كنند .
موتورهای حرارتی و سایر دستگاه های چرخه ای ، عموما ً شامل یك سیال می باشند كه در حین تكمیل چرخه ، حرارت به آن انتقال یافته و از آن خارج می شود و به آن سیال عامل گفته می شود .
چرخه كار نو
بازده یك چرخه موتور حرارتی بستگی زیادی به چگونگی هر یك از فرآیندهای تشكیل دهنده ، چرخه دارد . در نتیجه بازده چرخه، را می توان با به كار گیری فرایندهایی كه نیاز به كار ورودی كمتری داشته ولی دارای بیشترین كار خروجی می باشند ، یعنی به كارگیری فرآیندهای برگشت پذیر ، به حد اكثر رساند . شاید آشنا ترین چرخه برگشت پذیر ، چرخه كارنو باشد كه در سال 1824 به وسیله یك مهندس فرانسوی به نام سعدی كارنو ، پیشنهاد شد . موتور حرارتی تئوری كه در چرخه كارنو كار می كند ، موتور حرارتی كارنو نامیده می شود . چرخه كارنو شامل چهار فرآیند برگشت پذیر می باشد – دو فرآیند دما ثابت و دو فرآیند آدیاباتیك و می تواند در یك سیستم بسته یا یك سیستم جریان – دائمی ، عمل نماید .
نكاتی در مورد آنتروپی
با توجه به بحثی كه انجام شد ، میتوانیم نتایج زیر را بدست آوریم :
1. فرآیندها فقط می توانند در جهت معینی انجام شوند . نه در هر جهتی ، یك فرآیند باید در جهتی انجام شود كه اصل اتفزایش آنتروپی را برآورد ، یعنی Sgen ³ ◦ . این اصل اغلب واكنش های شیمیایی را مجبور می سازد كه قبل از كامل شدن متوقف شوند .
2. آنتروپی یك خاصیت غیر بقایی می باشد و چیزی به نام اصل بقای آنتروپی وجود ندارد . آنتروپی تنها در طول فرآیندهای واقعی افزایش می یابد و بنابراین آنتروپی جهان به طور مداوم افزایش می یابد .
3. عملكرد سیستم های مهندسی به دلیل وجود برگشت ناپذیرها تنزل می یابد و تولید آنتروپی مقیاسی برذای سنجش بزرگی مقدار برگشت ناپذیرهای موجود در طول یك فرآیند می باشد . هرچه مقدار برگشت ناپذیرها بیشتر باشد ، تولید آنتروپی به مقدار بیشتری انجام می شود .
بنابراین آنتروپی می تواند به عنوان یك مقیاس كمی برای برگشت ناپذیرهای مربوط به فرایند استفتده شد . همچنین می تواند به عنوان معیاری برای عملكرد
دستگاه های مهندسی مورد استفاده قرار گیرد .
سيستم ترموديناميكی و حجم كنترلی
سیستم ترمودینامیكی وسیله یا تركیبی از وسائل محتوی مقداری ماده است . برای تعریف دقیق تر این مطلب حجم كنترلی ای انتخاب می شود كه ماده و وسائل داخل سطح كنترلی را در برمی گیرد . هر آنچه خارج حجم كنترلی باشد ، محیط اطراف است و عمل جدایی را سطح كنترلی انجام میدهد . این سطح ممكن است نسبت به جریان های جرمی باز یا بسته و نسبت به انتقال گرما و كار در عرص آن دارای جریان های انرژی باشد . مرزها ممكن است كتحرك یا ساكن باشد . وقتی كه سطح كنترلی نسبت به جریان جرمی بسته است هیچ جرمی نمی تواند وارد حجم كنترلی یا از آن خارح شود آن را جرم كنترلی می نامند كه در تمام مدت حاوی مقدارماده ثابتی است .
نظر ماكروسكوپيك نسبت به ميكروسكوپيك
بررسی رفتار سیستم ممكن است از دید میكروسكوپیك یا ماكروسكوپیك انجام شود . اكنون به طور خلاصه سیستمی را از دید میكروسكوپیك بررسی می كنیم . سیستمی را شامل مكعبی به ضلع mm 25 حاوی گاز تك اتمی به فشار و دمای جو در نظر بگیرید . این حجم تقریبا ً دارای 1020 اتم است .
بنابراین برای بیان كامل رفتار این سیستم از نظر میكروسكوپیك حداقل باید 1020 × 6 معادله را برسی كنیم این عمل حتی با كامپیوتر دیجیتالی بزرگ نیز كار محاسباتی كاملا ً ب ینتیجه ای است . برای این مسئله دو رهیافت وجود دارد كه تعداد معادلات و متغیرها را به چند عدد كاهش می دهد كه می توان آنها را نسبتا ً ساده حساب كرد . یكی از این رهیافت ها آماری است كه در آن بر پایه ملاحظات آماری و نتیجه احتمالات ” متوسطی ” را برای تمام ذرات تحت برسی در نظر می گیریم . این عمل در رابطه با مدلی از اتم تحت بررسی انجام می شود . از این رهیافت در نظاماتی مرسوم به نظریه جنبشی و مكانیك آماری استفاده می ش.دئ .
رهیافت دیگر كه تعداد متغیر ها را به چند متغیر قابل بررسی كاهش می دهد منظر ماكشروكوپیك ترمودینامیك كلاسیك است . همانطور كه از لغت ماكروسكوپیك برمی آید ما با آثاربزرگ و متوسط مولكول های بسیاری سر و كار داریم .این آثار را می توان حس و با ابزار اندازه گیری كرد . گرچه آنچه ما واقعا ً حس می كنیم و اندازه می گیریم اثر از نظر زمانی متوسط مولكولهای زیادی است . برای مثال فشار گاز روی دیواره های ظرف خودش را در نظر بگیرید . این فشار از تغییر اندازه حركت مولكول ها ضمن اصابت آنها به دیواره ظرف ناشی می شود .گرچه از نظر ماكروسكوپیك علاقه مند به اثر تك تك مولكول ها نیستیم بلكه به نیروی از نظر زمانی متوسط اعمال شده روی سطحی معین علاقه مندیم كه می توان آنرا با فشار سنج اندازه گیر یكرد . د رواقع این ملاحظات ماكروسكوپیك كاملا ً مستقل از فرض های ما در مورد سرشت ماده است .
در مورد پیوستگی نیز چند مورد را یاد آور می شویم
همواره از نظر ماكروسكوپیك به حجم های علاقه داریم كه در مقایسه با ابعاد مولكولی خیلی بزرگ است و بنابر این به سیستم هایی علاقه مندیم كه مولكولهای بسیار دارند و از آنجا كه علاقه ای به رفتار تك تك مولكول ها نداریم . می توانیم ماده را به صورت پیوسته در نظر بگیریم و از عمل تك تك مولكول ها صرف نظر كنیم ؛ این را پیوستگی می گوئیم . البته مفهوم پیوستگی فقط یك فرض راحت است و اگر مسیر آزاد متوسط مولكولها به مرتبه بزرگی ابعاد ظرف نزدیك شود ، هملنطور كه مثلا ً در تكنولوژی خلا ء – بالا وجود دارد این فرض اعتبار خود را از دست می دهد . در بسیاری از كارهای مهندسی فرض پیوستگی معتبر و مناسب است و با دید ماكروسكوپیك پیش می رود .
خاصه ها و حالت ماده
جرم معینی آب را در نظر می گیریم . می دانیم كه این آب می تواند به شكل های مختلف وجود داشته باشد . اگر ابتدا آب به صورت مایع باشد با گرما بخار و با سرما یخ می شود . بنابر این از فازهای مختلف ماده صحبت مب كنیم و فاز به صورت مقدار نعینی از ماده همگن تعریف می شود . اگر بیش از یك فاز وجود داشته باشد با مرزهای فازی از یكدیگر جدا می شود . ممكن است در هر فاز ماده به فشارها و دماهای مختلف موجود باشد و چنانچه از واژه های ترمودینامیكیاستفاده كنیم . در حالت های مختلف حالت را می توان با بعضی خاصه های ماكروسكوپی قابل مشاهده ، مشخص یا بیان كرد ؛ بعضی از این خاصه های آشنا عبارتند از : دما ، فشار ، چگالی .
هر یك از خاصه های ماده در حالی معین همواره مقداری معین دارد وبه این كه این ماده چگونه به آن حالت رسیده ، ربطی ندارد. در حقیقت خاصه را می توان به عنوان كمیتی تعریف كرد كه به حالت سیستم بستگی دارد و به مسیر رسیدن به سیستم به آن حالت معین بستگی ندارد . بالعكس حالت بوسیله خاصه ها مشخص یا بیان می شود و بعداً تعداد خاصه های مستقلی را كه یك ماده می تواند داشته باشد یعنی حداقل تعداد خاصه ها برای تعیین حالت یك ماده معین را بررسی می كنیم .
خاصه های ترمودینامیكی را می توان به دو دسته عمومی ، خاصه های متمركز و گسترده تقسیم كرد . خاصه متمركز مستقل از جرم است و مقدار خاصه گسترده با جرم تغییر می كند . بنا براین اگر مقداری از در حالتی به دو قسمت مساوی تقسیم گردد ، خاصه های متمركز هر قسمت همان مقدار اصلی و مقدار خاصه های گسترده آن نصف مقدار اصلی است . فشار ، دما و چگالی نمونه هایی از خاصه های متمركز هستند . جرم و حجم كلی نمونه های از خاصه گسترده اند . خاصه های گسترده به ازای واحد جرم ، مثل حجم ویژه ، خاصه های متمركز هستند . گاهی نه تنها از خاصه ها ماده بلكه خاصه های سیستم صحبت می كنیم و می خواهیم بگوئیم كه مقدار آن خاصه برای كل سیستم دارای اهمیت است . و این دلالت بر تعادل دارد .
تغییر در فشار نسبت به ارتفاع به علت آثار نیرو های گرانشی وجود دارد ، گرچه در شرایط تعادل تمایلی به به اینكه فشار در جایی تغییر كند وجود ندارد . گرچه در بسیاری از مسائل ترمودینامیكی این تغییر در فشار نسبت به ارتفاع آن قدر كوچك است كه می توان از آن صرف نظر كرد . وقتی سیستمی با توجه به تمام تغییرات حالت احتمالی ، در حال تعادل است می گوییم سیستم در حال تعادل ترمودینامیكی است .
فرآيند ها و چرخه ها
وقتی كه یك یا چند خاصه سیستم تغییر كند ، می گوییم تغییر حالت رخ داده است مثلا ً وقتی یكی از وزنه های روی پیستون برداشته شود ، پیستون بالا می رود و تغییر حالت اتفاق می افتد زیرا فشار كاهش و حجم ویژه افزایش می یابد . مسیر رشته حالت هایی كه سیستم از آن عبور می كند ، فرآیند نامیده می شود .اكنون تعادل سیستمی را كه تغییر حالت می دهد بررسی می كنیم .
لحظه ای كه وزنه از روی پیستون برداشته شود تعادل مكگانیكی به هم خورده و پیستون به سمت بالا حركت می مند تا دوباره تعادل مكانیكی برقرار شود . سؤال این است كه : چون خاصه ها حالت سیستم در حال تعادل را بیان می كند ، چگونه می توان حالت های سیستم طی فرآیند را تعریف كرد د رحالی كه فرآیند واقعی وقتی اتفاق می افتد كه تعادل وجود ندارد ؟
یك مرحله در پاسخ به این سؤال به تعریف فرآیندی ایده آل مربوط می شود كه آن را فرآیند شبه تعادلی می نامیم یعنی فرآیندی كه در آ‹ انحراف از تعادل تمودینامیكی آن بسیار كوچك است و تمام حالت هایی حالت هایی كه سیستم طی فرآیند شبه تعادلی از آنها عبور می كند را می توان حالت های تعادل در نظر گرفت . بسیاری از فرآیندهای واقعی خیلی به فرآیند شبه تعادلی نزدیك تر است و می توان آنها را بدون خطای فاحشی به همین صورت در نظر گرفت . اگر وزنه های زوی پیستون كوچك بوده و یكی یكی برداشته شوند ، فرآیند را می توان شبه تعادلی در نظر گرفت . امااگر تمام وزنه ها به یكباره برداشته شوند ، پیستون ناگهان بالا می رود تا به متوقف كننده ها اصابت كند . این فرآیند غیر تعادلی است و سیستم در هر لحظه این تغییر حالت در حال تعادل نخواهد بود